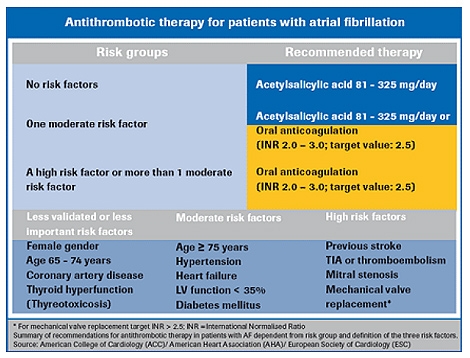
En almindelig indikation for warfarin-behandling plus monitorering
Atrieflimren
Atrieflimren er den hyppigste hjerterytmefejl hos folk. Under atrieflimren banker de to forkamre (atrier) kaotisk og uregelmæssigt. Tilstanden giver dårlig blodgennemstrømning og dannelse af blodkoageler i hjertet, som kan løsne sig, føres til hjernens arterier og give et slagtilfælde. Det er primært et problem hos ældre.
Atrieflimren klassificeres ofte på følgende måde:
- Tilbagevendende atrieflimren: to eller flere episoder med atrieflimren
- Paroksystisk atrieflimren: episoden ophører spontant af sig selv inden for 7 døgn
- Persisterende atrieflimren: medicinsk behandling eller elektrisk stød er nødvendigt for at standse arytmien
- Permanent atrieflimren: Vedvarende atrieflimren trods behandling til standsning af arytmien, eller hvis kardioversion ikke er velegnet
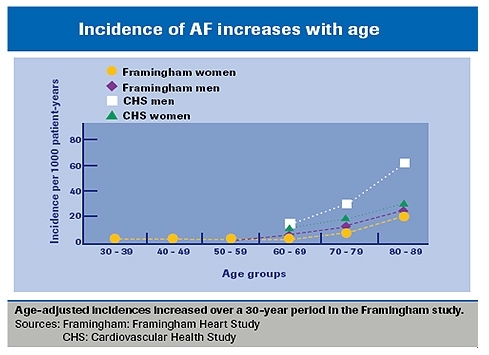
Ca. 15 % af slagtilfælde opstår hos patienter med atrieflimren. Risikoen for slagtilfælde hos patienter med atrieflimren øges med alderen, fra en årlig risiko på 1,5 % hos patienter i alderen 50-59 år til 23,5 % hos patienter i alderen 80-89 år. Ældre patienter med atrieflimren har den højeste risiko for slagtilfælde og den højeste risiko for blødning. Efter justering for komorbide kardiovaskulære forhold er atrieflimren forbundet med en 50 % til 90 % stigning i mortalitet. Slagtilfælde er desuden en primær årsag til alvorlige permanente handicap.
Antikoagulation
Fem relevante kliniske studier – AFASAK, SPAF, BAATAF, CAFA og SPINAF – har påvist fordele ved warfarin til forhindring af slagtilfælde hos patienter med atrieflimren. Under en INR på 2,0 har patienter en øget risiko for iskæmisk slagtilfælde, og over 3,0 begynder risikoen for intrakraniel blødning at stige.
Ifølge et stort europæisk studie af atrieflimren af Hart et al., der involverede over 1.000 patienter, blev der opnået en risikoreduktion fra 12 % til 4 % for dette kliniske billede. Med andre ord kan antallet af slagtilfælde reduceres med 80 for hver 1.000 patienter, der behandles med antikoagulerende midler.
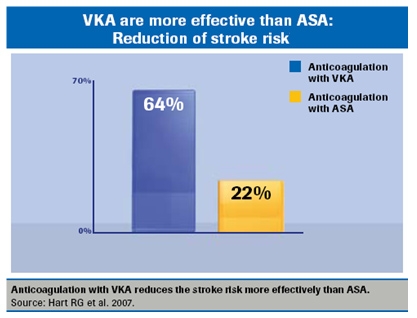
Dette er for nyligt blevet bekræftet af BAFTA-studiet, som viste, at risikoen for slagtilfælde reduceres med 64 % og død med 25 % ved behandling med vitamin K-antagonister sammenlignet med ingen behandling, og slagtilfælde reduceres med 22 % ved behandling med trombocythæmmende lægemidler.
Warfarin er 40 % mere effektivt end behandling med trombocythæmmende lægemidler og er velegnet til behandling af ældre mennesker.